Wie wird ein GIST behandelt?
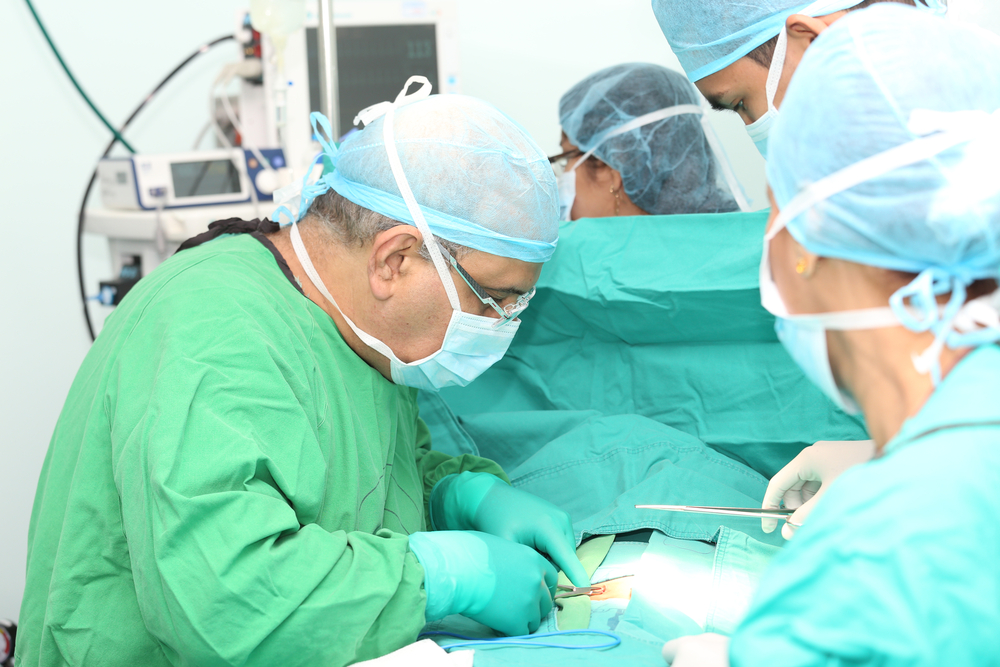
I. OPERATIVE THERAPIE
Um einen Patienten mit einem Gastrointestinalen Stromatumor operativ heilen zu können, ist es notwendig, sowohl makroskopisch (Makroskopie: „grobe Betrachtung” – gr. Μακρός = weit, groß und Σκοπείν = beobachten, betrachten) als auch mikroskopisch (d. h. mit bloßem Auge nicht mehr erkennbar) alle Tumorzellen zu entfernen, was bedeutet, dass von chirurgischer Seite eine sogenannte RO-Resektion vorliegen muss. Bereits vor der Operation ist anhand der bereits eingangs erwähnten diagnostischen Schritte zu klären, ob es sich um einen primär resektablen GIST handelt. Ein lokal fortgeschrittenes Tumorstadium oder eine offensichtlich metastasierte Tumorsituation verlangen, nach dem derzeitigen Stand des Wissens, andere therapeutische Ansätze, wie etwa eine medikamentöse Therapie vor einer Operation, oder einen alleinigen medikamentösen Behandlungsansatz.
TUMORSYMPTOMATIK: Die Beschwerden eines gastrointestinalen Stromatumors sind in vielen Fällen abhängig von der Lokalisation des Tumors. Von unspezifischen Schmerzen bis hin zum massiven Blutverlust, sei es im Rahmen eines Erbrechens oder mit der Stuhlentleerung, oder bis hin zum Darmverschluss oder Durchbruch eines Hohlorgans, kann die Tumorsymptomatik dominiert sein. Nicht allzu selten sind es auch nur indirekte Hinweise, wie etwa eine zufällig entdeckte Blutarmut im Rahmen einer Laboruntersuchung oder ein nicht erklärbarer Gewichtsverlust, die Anlass zu einer Durchuntersuchung geben und damit die Diagnose aufdecken. Auch das Ausmaß eines primär operablen gastrointestinalen Stromatumors richtet sich nach dem Entstehungsort des Tumors.
VERTEILUNGSMUSTER DES ENTSTEHUNGSORTES: Das prozentuelle Verteilungsmuster des Entstehungsortes eines GIST wird in der Literatur wie folgt angegeben:
Bevor auf die einzelnen Organe speziell eingegangen wird, sei nochmals auf die Notwendigkeit einer radikalen Operation, nämlich mit tumorzellfreien Operationsrändern und dem Erhalt der bei GIST bestehenden Pseudokapsel, hingewiesen. Kann dieses Management im Falle des Ersteingriffes nicht erzielt werden, so muss von therapeutischer Seite klar sein, dass ein eventuell operativ heilbarer Zustand in eine metastasierte Behandlungssituation übergeführt wird. Eine Lymphknotenchirurgie, wie sie in anderen Bereichen der onkologischen Chirurgie vonnöten ist, ist im Falle eines GIST nicht indiziert, da die Metastasierungsrate in den Lymphknoten, laut Literatur, mit Ausnahme diverser familiärer Syndrome und des kindlichen GIST, bei 1,5–2% liegt.
SPEISERÖHRE: Die Speiseröhre ist relativ selten Ursprungsorgan für einen GIST. Nahezu zwei Drittel aller hier entstehenden mesenchymalen Tumore sind Leiomyome, also gutartige Tumore der Muskelschichte, nur rund 25% dieser Neubildungen sind GIST. Tumore unter 2 cm Durchmesser können, ähnlich dem Magen, einem konservativen Management zugeführt werden. Regelmäßige endoskopische und endosonographische (endoskopischer Ultraschall) Kontrollen sind unerlässlich.
Das Kontrollintervall ist abhängig vom Lokalbefund, variiert jedoch in den meisten Fällen zwischen sechs und zwölf Monaten. Welches chirurgische Verfahren Anwendung findet, hängt von der Größe und Lokalisation des GIST ab. In manchen Fällen kann mit einer einfachen, möglicherweise auch endoskopisch durchführbaren Technik das Auslangen gefunden werden. Vorsicht ist insofern geboten, als der GIST Verbindungen zur angrenzenden Muskelschichte aufweisen kann und damit mit einer einfachen Tumorausschälung, genannt Enukleation, nicht radikal, im Sinne einer RO-Resektion, behandelt wird. In diesen Fällen wäre eine Nachresektion, sofern es der Allgemeinzustand des Patienten zulässt, die weitere Konsequenz. Operationen an der Speiseröhre ziehen nicht selten eine Eröffnung zweier Körperhöhlen, sprich des Brustkorbs und der Bauchhöhle, nach sich, was ein gutes präoperatives und postoperatives Management voraussetzt. Aus diesem Grund sollten manche dieser Operationen in diesbezüglich spezialisierten Zentren durchgeführt werden.
MAGEN: Der Magen als häufigstes Ursprungsorgan des GIST bietet, bei primär gegebener radikaler Operationsmöglichkeit, eine breite Palette an Resektionsverfahren. Welche chirurgische Strategie zur Anwendung kommt, hängt einerseits von der Lokalisation im Magen, andererseits aber auch vom Durchmesser des Tumors selbst ab.
In den mageneingangsnahen bzw. zentralen Anteilen führen sogenannte Wedge-Resektionen, sei es als offenes Verfahren – also mit Bauchschnitt – oder laparoskopisch – d. h. geschlossene OP-Technik mit Sondeninstrumenten – zu einem relativ einfachen, operativen Erfolg, wobei die Tumorgröße und die Erfahrung des Zentrums die eine oder andere Operationsmethode in den Vordergrund stellen.
Je näher der Tumor an den Übergangsbereich der Speiseröhre oder den Magenausgang heranreicht, umso ausgedehnter wird meist das Resektionsausmaß. Ein „Ausschneiden“ des Tumors ist – in diesen Regionen – aus funktionell anatomischen Gründen und aus Radikalitätsgründen meist nicht mehr möglich, was größere resezierende Verfahren, wie etwa die Entfernung zweier Drittel oder des ganzen Magens, nach sich ziehen kann.
MICRO-GIST: Diskussionspunkt sind nach wie vor kleine GIST unter 2 cm Durchmesser – nämlich, ob und wann sie operiert werden sollen oder müssen. Es gibt ausgedehnte Autopsiestudien, die zeigen, dass sehr viele Verstorbene als Zufallsbefund ein oder mehrere kleine GIST des Magens ohne Krankheitswert aufweisen. Was diese zufällig entdeckten Tumore veranlasst zu wachsen, ist noch unklar. Tatsache ist, dass in allen Guidelines Einigkeit besteht, im Falle eines Größenwachstums über 2 cm eine Entfernung des Tumors in Erwägung zu ziehen. Dennoch sei nochmals auf die konsequente Kontrolle im Falle eines konservativen, d.h. nicht operativen, Konzeptes hingewiesen.
ZWÖLFFINGERDARM: Gastrointestinale Stromatumore des Zwölffingerdarmes sind verglichen mit dem Magen zwar relativ selten, doch in der operativen Behandlungsstrategie oft viel aufwendiger. Im Falle kleiner Tumore und entsprechender Distanz von der Einmündungsstelle des Hauptgallenganges kann mit einer lokalen Entfernung das Auslangen gefunden werden. Je näher die Tumore jedoch an diese Stelle heranreichen und je größer ihr Durchmesser ist, umso höher liegt die Wahrscheinlichkeit, dass mit einem lokalen operativen Verfahren keine Tumorfreiheit oder entsprechende mit dem Leben vereinbare Rekonstruktion zu erreichen ist. In diesen Fällen müssen dann Operationen mit Entfernung mehrerer Organanteile (Multiviszeralresektion) ähnlich denen, die bei Erkrankungen der Bauchspeicheldrüse angewendet werden, durchgeführt werden. Diese Eingriffe sind mit gewissen Komplikationsraten behaftet und bedürfen eines entsprechenden prä- und postoperativen Aufwandes, was für Zentren mit entsprechender Erfahrung spricht.
DÜNNDARM: 20–35% aller GIST entstehen im Dünndarm. Wegen der relativ aufwendigen diagnostischen Erreichbarkeit bleiben diese Tumore häufig lange unentdeckt und werden erst durch entstehende Komplikationen, wie Darmverschluss, Blutungen und Perforationen, häufig erst im Rahmen einer Akutoperation, erkannt. Leider sind zum Diagnosezeitpunkt nur rund 25% der Tumore auf den Dünndarm beschränkt. In den meisten dieser Fälle kann eine relativ einfach durchzuführende Entfernung des entsprechenden Darmabschnittes durchgeführt werden. Ob dies laparoskopisch oder mittels Bauchschnitt erfolgt, hängt von der Erfahrung des behandelnden Zentrums ab, hat aber keinen Einfluss auf den Erfolg der Operation. 50% zeigen bereits Kontakt zu benachbarten Organen, was ausgedehnte Operationsverfahren, im Sinne einer multiviszeralen Resektion (Mehrorganresektion), zur Folge haben kann. Prognostisch deutlich benachteiligt sind jene 20%, die bereits zum Diagnosezeitpunkt Metastasen aufweisen. Bei diesen Patienten ist die operative Therapie nicht vordergründig.
DICK-, MASTDARM: Gemeinsam mit dem Mastdarm sind 5–15% der GIST im Dickdarm lokalisiert. Ähnlich anderen Tumoren des Dickdarmes sind 90% mittels Entfernung der rechten bzw. linken Hälfte des Dickdarmes, ohne Anlage eines künstlichen Darmausganges, therapierbar. Nur etwa 10% der GIST im Dickdarm können mittels lokaler Tumorentfernung operiert werden. Etwas anders verhält sich die Strategie bei den Stromatumoren des Mastdarmes (Rektum). Zwar ist auch hier die Chirurgie mit der entsprechenden R0-Resektion eine Therapie der Wahl, doch ist infolge der Lagebeziehung zum Schließmuskel besondere Vorsicht geboten. Ist mittels präoperativer Abklärung nicht sicher ausschließbar, dass der Schließmuskelapparat tumorfrei und bei der Operation erhaltbar ist, so ist die (neo-) adjuvante Imatinibtherapie auf jeden Fall in Erwägung zu ziehen. Ausgedehnte und verstümmelnde Operationen bringen keinen Überlebensvorteil, verschlechtern aber die Lebensqualität enorm.
Der größte Anteil der Operationen wird, nach wie vor, vom Bauch aus operiert, wobei die Mobilisierung des Mastdarmes sehr wohl laparoskopisch erfolgen kann. Diverse lokal resezierende Verfahren, sei es durch einen transanalen (durch den Anus), transvaginalen (durch die Scheide) oder transsacralen (neben dem Kreuz-, Sitz-Bein) Zugang, zeigen gegenüber den aufwendigeren Baucheingriffen eine höhere Lokalrezidivrate, d. h., die Gefahr eines neuerlichen Tumors an der operierten Stelle ist erhöht, bei etwas niedrigerer Komplikationsrate.
E-GIST: Laut Literatur sind ca. 1,5% aller GIST so genannte E-GIST, d.h. Stromatumore, die keines der genannten Organe als Ursprungsorgan aufweisen, sondern ohne eine entsprechende Organzugehörigkeit entstehen. Prinzipiell ist anzunehmen, dass diese Tumore im Laufe ihres Wachstums die Organzugehörigkeit verlieren, und diese oft nur mehr durch zarte intraoperative Verklebungen erahnt werden kann, weswegen diese chirurgischerseits nicht achtlos gelöst werden sollten.
ERKRANKUNGSFREIES INTERVALL BEI PRIMÄR OPERABLEM GIST: Abschließend sei nochmals auf den Benefit der Chirurgie im Falle eines primär operablen GIST hingewiesen. Das erkrankungsfreie Intervall liegt, wie eine Studie von DeMatteo 2008 zeigt, nach einem Jahr bei 83%, nach zwei Jahren bei 75% und nach zehn Jahren bei 60%. Faktoren, die dieses Intervall beeinflussen, sind die Höhe der Zellteilungsrate, das Ursprungsorgan und der Durchmesser des Tumors. Somit wird klar, dass es kein standardisiertes „Rezept“ für alle Tumore geben kann, sondern dass jeder Tumor bzw. jede/r PatientIn einer individualisierten Therapie bedarf.
II. MEDIKAMENTÖSE THERAPIEN
Vorweg muss einmal festgestellt werden, ob es sich um eine lokalisierte, lokal fortgeschrittene oder metastasierte Erkrankung handelt.
- Lokalisierte Erkrankung: Der GIST ist nur an einer Stelle im Körper zu finden (z. B. im Magen) und kann leicht operiert werden
- Lokal fortgeschrittene Erkrankung: Der GIST ist zwar nur an einer Stelle im Körper zu finden, liegt aber so ungünstig oder ist so groß, dass eine Operation prinzipiell durchführbar ist. Diese Operation wäre aber sehr kompliziert, weil z. B. ein ganzes Organ oder sogar mehr Organe entnommen werden müssten (z. B. der Magen, die Bauchspeicheldrüse, Milz).
- Metastasierte Erkrankung: Hier hat der GIST Metastasen (= Tochtergeschwülste) gesetzt. Das heißt GIST-Zellen haben sich z. B. in der Leber und/oder im Peritoneum (= Bauchfell) angesiedelt. Metastasen können sich im Verlauf der GIST-Erkrankung entwickeln oder schon bei der Erstdiagnose vorhanden sein.
GIST kann bei den meisten PatientInnen sehr gut behandelt werden. Derzeit gibt es drei in der GIST-Behandlung registrierte Substanzen, die alle in Tablettenform zur Verfügung stehen:
1) Imatinib (Glivec®): zugelassen in der adjuvanten (= vorbeugenden) Therapie, nachdem ein GIST entfernt wurde und in der Erstlinientherapie des metastasierten GIST.
2) Sunitinib (Sutent®): zugelassen in der Zweitlinientherapie des metastasierten GIST, wenn Imatinib (Glivec®) nicht mehr wirkt oder wenn Imatinib (Glivec®) nicht vertragen wird.
3) Regorafenib (Stivarga®): Regorafenib ist ein in Tablettenform verfügbarer sogenannter Multi-Tyrosinkinase- Hemmer, der unter anderen KIT, PDGFRB und VEGFR hemmt. Regorafenib ist von der Europäischen Kommission zur Behandlung von erwachsenen Patienten mit inoperablen oder metastasierten GIST zugelassen worden, deren Tumor unter der Behandlung mit imatinib oder sunitinib weiter fortgeschritten ist oder die diese Medikamente nicht vertragen haben.
Imatinib (Glivec®), Sunitinib (Sutent®) und Regorafenib (Stivarga®) sind wie gesagt in Tablettenform einzunehmen. Sie wirken hemmend auf das Wachstum von GIST-Zellen. Der Wirkmechanismus und das Nebenwirkungsprofil sind allerdings unterschiedlich.
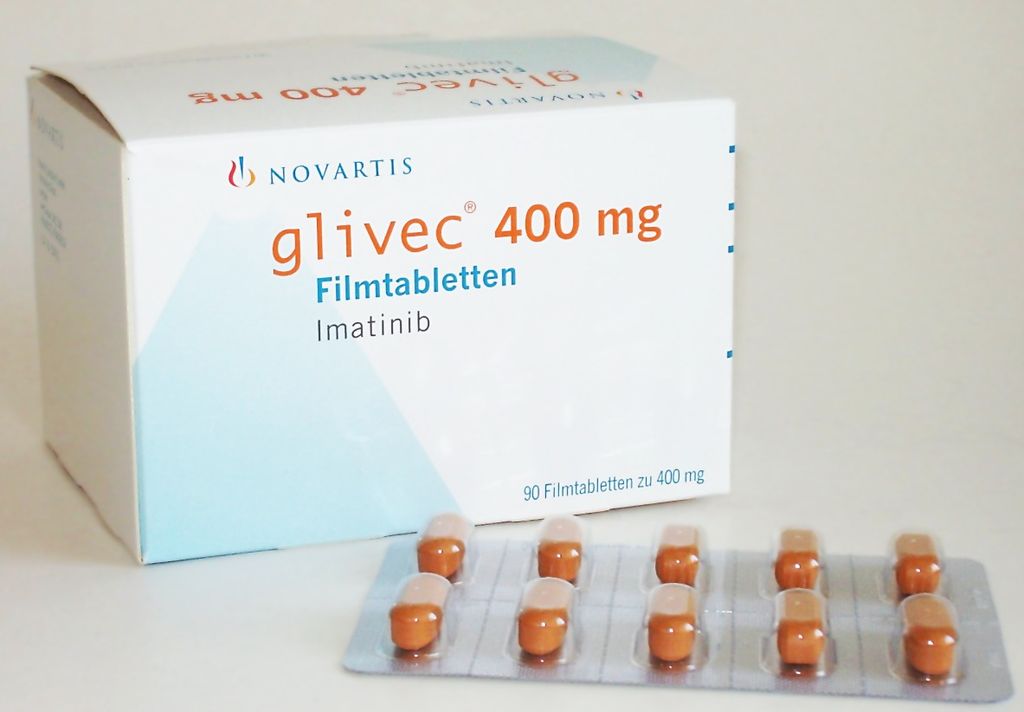
ADJUVANTE THERAPIE: Eine adjuvante Therapie heißt, dass der GIST operativ komplett entfernt wurde, KEIN Hinweis auf eine Fernmetastasierung besteht und NACH der Operation eine medikamentöse Therapie mit Imatinib (Glivec®) durchgeführt wird, um ein Wiederauftreten des GIST zu verhindern oder zumindest zu verzögern.
Wer soll eine adjuvante Therapie mit Imatinib (Glivec®) bekommen? Folgende Parameter werden für die Indikation zur adjuvanten Therapie mit Imatinib (Glivec®) herangezogen:
– Tumorgröße (≤ 2 cm; > 2 cm – ≤ 5 cm; > 5 cm – ≤ 10 cm; > 10 cm)
– Tumorlokalisation (Magen; Zwölffingerdarm; Dünndarm; Dickdarm/Enddarm)
– Mitoseanzahl (= Zellteilungsaktivität) (≤ 5 pro 50 HPF; > 5 pro 50 HPF)
– Mutationstatus (bestimmte Abschnitte des KIT-Gens und des PDGFRA-Gens)
Anhand der Tumorgröße, der Tumorlokalisation und der Mitoseanzahl wird ein sogenanntes Risikoprofil erstellt. Dieses Risikoprofil sagt aus, in wie viel Prozent der PatientInnen mit genau denselben oben erwähnten Tumorkriterien der GISTTumor nach erfolgter kompletter Entfernung wieder auftreten kann, sprich metastasiert. Ein Risiko von z. B. 20% bedeutet, dass von 100 PatientInnen mit genau derselben Tumorgröße, genau derselben Tumorlokalisation und genau derselben Mitoseanzahl bei 20 PatientInnen der GIST wieder kommt, meist in Form von Metastasen.
UNTERTEILUNG DER RISIKOGRUPPEN IN VIER UNTERGRUPPEN: 
PatientInnen mit hohem Risiko soll eine adjuvante Therapie mit Imatinib (Glivec®) empfohlen werden. Bei PatientInnen mit moderatem Risiko soll eine adjuvante Therapie mit Imatinib (Glivec®) individuell erwogen werden. Der oben erwähnte Mutationsstatus hilft weiter, um festzustellen, welche PatientInnen mit hohem oder moderatem Risiko auch wirklich von dieser Therapie profitieren. D. h., bei diesen PatientInnen soll auch eine Mutationsanalyse durchgeführt werden. Dabei werden Genabschnitte des GIST untersucht.
Bei folgenden Mutationen ist bei Hochrisiko und selektiertem, moderatem Risiko eine adjuvante Therapie indiziert:
- EXON 11
- PDGFRA (außer bei D842V)
- EXON 9 (hier kann sogar überlegt werden, ob nicht eine höhere Dosierung von Imatinib (Glivec®) sinnvoll ist.
Bei folgenden Mutationen ist KEINE adjuvante Therapie indiziert:
- D842V
- Wildtype: Hier wird individuell zu entscheiden sein.
DAUER DER ADJUVANTEN THERAPIE: Der Therapiestandard in der adjuvanten Behandlung von KIT positiven high risk GIST-PatientInnen ist Imatinib 400 mg/d für drei Jahre. Im Rahmen einer großen Studie wurde ein Jahr versus drei Jahre adjuvant Imatinib (Glivec®) bei KIT positiven high risk GIST-Patienten verglichen. Die Ergebnisse waren beeindruckend zu Gunsten der PatientInnen, die drei Jahre lang behandelt wurden.
THERAPIE BEI DER METASTASIERTEN GIST-ERKRANKUNG: Wenn Metastasen (Ansiedelung von GIST-Zellen vor allem in der Leber und/oder im Bauchfell) auftreten, spricht man von einer metastasierten GIST-Erkrankung. Die Standardtherapie hierbei ist Imatinib (Glivec®), 400 mg/Tag, bei einer Exon 9 Mutation (siehe oben) Imatinib (Glivec®), 800 mg/Tag.
Die Therapie mit Imatinib (Glivec®) ist eine Dauertherapie, d. h., sie wird so lange gegeben, wie die betroffenen PatientInnen davon profitieren (das heißt, solange der Tumor unter Kontrolle ist und nicht wächst). Wenn das Imatinib (Glivec®), 400 mg/Tag, nicht mehr hilft, sprich der Tumor und/oder die Metastasen wachsen, soll das Imatinib (Glivec®) auf 800 mg/Tag gesteigert werden. Die 800 mg/Tag sollen dann wieder als Dauertherapie so lange gegeben werden, wie die PatientInnen davon profitieren (das heißt, solange der Tumor unter Kontrolle ist und nicht wächst). Wenn das Imatinib (Glivec®), 800 mg/Tag, nicht mehr hilft, sprich der Tumor und/oder die Metastasen wachsen, soll das Imatinib (Glivec®) abgesetzt werden und eine Therapie mit Sunitinib (Sutent®) begonnen werden. Das Sunitinib (Sutent®) ist auch eine Dauertherapie. Die Dosierung von Sunitinib (Sutent®) ist 37,5 mg/Tag. Auch das Sunitinib soll so lange gegeben werden, wie die PatientInnen davon profitieren (das heißt, solange der Tumor unter Kontrolle ist und nicht wächst).
Im Falle der Gastrointestinalen Stromatumore sind derzeit folgende neue Substanzen in Erprobung:
Nilotinib, Sorafenib, Everolimus, Dasatinib: Diese Substanzen gehören, wie auch die Medikamente der Erst- und Zweitlinie, zu den sogenannten „Targeted Therapies” (zielgerichtete Krebstherapien). Dabei werden nicht, wie bei herkömmlichen Zytostatika, die schnellwachsenden Tumorzellen einfach zerstört, sondern es sollen bestimmte Ziele in den erkrankten Zellen erreicht werden und dabei gewisse Stoffwechselvorgänge blockiert und die Zelle dadurch an weiterer Teilung und Wachstum gehindert werden.
Die Target-Therapien sind deshalb besser verträglich und haben deutlich weniger Nebenwirkungen als die herkömmlichen zytostatischen Krebstherapeutika. Dieser Umstand und auch die Verabreichung in Tablettenform, die die PatientInnen unabhängiger von Ärztin/Arzt und Krankenhaus macht, führen zu einer besseren Mitarbeit und Verlässlichkeit (Compliance) der PatientInnen.
Nilotinib (Tasigna®): Nilotinib ist ein sogenannter Tyrosinkinaseinhibitor, ein Hemmstoff eines (als Proteinkinase bezeichneten) Enzyms, das eine entscheidende Rolle bei der Vermehrung der Zellen spielt.
Ursprünglich zugelassen ist es zur Behandlung einer chronischen Bluterkrankung, der chronisch myeloischen Leukämie. Man hat beobachtet, dass es eine wachstumshemmende Wirkung auf Zellen, die gegenüber Imatinib eine Resistenz entwickelten, besitzt.
Als Nebenwirkungen können auftreten: Hautausschläge, Juckreiz, Müdigkeit, Übelkeit, Muskel- und Gelenksschmerzen, Bauchschmerzen, Verdauungsprobleme (Verstopfung bis Durchfall) und geschwollene Beine. Diese Nebenwirkungen sind jedoch selten und meist nur von geringer bis mittelgradiger Schwere und sollten als Erstes symptomatisch behandelt werden (z. B. durch Abführmittel oder Medikamente, die die Darmbewegung und damit die Durchfälle hemmen, Schmerztherapie, lokale Hautbehandlung etc.). Sehr selten sind Fälle von Herzrhythmusstörungen bekannt geworden.
Unter der Therapie können auch hämatologische Toxizitäten auftreten. Das sind Nebenwirkungen, die wegen einer Unterdrückung der Bildung einzelner Blutzellreihen zustande kommen. Als Folge kann es zum Auftreten von Infektionen und Blutungen kommen. All diese Nebenwirkungen sind nach kurzem Absetzen von Nilotinib rückläufig.
Der Stellenwert von Nilotinib in der Behandlung von GIST steht letztendlich noch nicht fest und es muss entsprechend der noch nicht vollständig verfügbaren Ergebnisse diesbezüglich abgewartet werden.
Sorafenib (Nexavar®): Sorafenib ist ein Multikinase-Inhibitor, der mehrere Proteinkinasen der Zelle hemmt, und wurde ursprünglich für die Behandlung des Nierenzellkarzinoms zugelassen. Außerdem hemmt Sorafenib zusätzlich auch die Entwicklung neuer Blutgefäße, die die Krebszelle zum Wachstum benötigt.
Inzwischen liegt auch bei GIST eine Studie, allerdings mit nur kleinen Patientenzahlen, zur Viertlinientherapie nach Resistenz gegenüber Imatinib, Sunitinib und Nilotinib vor.
Die am häufigsten beobachteten Nebenwirkungen sind erneut: Magen-Darm- Beschwerden, Hautreaktionen, Hand-Fuß-Syndrom (Hautausschläge und Schmerzen an Handflächen und Fußsohlen), Müdigkeit, Erschöpfung und eher selten, die Veränderungen des Blutbildes, wie bereits oben beschrieben. Bei Hautreaktionen ist wieder eine Lokalbehandlung durch fettende Substanzen empfehlenswert. Bei schwer tolerierbaren Nebenwirkungen kann eine vorübergehende oder dauerhafte Unterbrechung der Sorafenib-Therapie notwendig werden.
Dasatinib (Sprycel®): Dasatinib stammt ebenfalls aus der Behandlung von Bluterkrankungen (Chronisch Myeloische Leukämie und Akute Lymphatische Leukämie) und steht derzeit in Erprobung im Einsatz gegen GIST. Es zählt zu den Multi- Kinase-Inhibitoren. Imatinib wurde erstmalig bei der chronisch myeloischen Leukämie (CML) mit hervorragenden Behandlungsergebnissen eingesetzt, was dann in weiterer Folge zum Einsatz bei GIST führte. An CML erkrankte PatientInnen, die nicht mehr auf Imatinib ansprachen, sprachen in der Mehrzahl auf eine Zweitlinien-Behandlung mit Dasatinib an, was zu einer Zulassung von Dasatinib geführt hat.
Die Verträglichkeit von Dasatinib in diesen klinischen Studien war gut. Dasatinib hemmt eine ganze Reihe sogenannter Tyrosinkinasen sehr wirksam und unabhängig vom Aktivierungsstatus des Rezeptor-Proteins. Die Hemmung mehrerer Kinasen (multitarget) könnte in der Behandlung von GIST Vorteile bringen.
Die häufigsten Nebenwirkungen sind: Flüssigkeitsansammlungen, etwa in Lunge oder Bauchhöhle, oder die bereits mehrmals angeführten Symptome, wie Schmerzen, Hautveränderungen und Beschwerden im Bereich des Magen-Darm-Traktes.
Everolimus (Certican®, Afinitor®): Diese Substanz zählt zu den mTOR-Inhibitoren. Das ist eine Klasse von Substanzen, die die Vermehrung von Tumorzellen durch Unterbindung einer ganz speziellen Signalkaskade hemmt.
Das Eiweiß mTOR ist wichtig für die Ernährung der Zelle. Bei dessen Ausschaltung durch Everolimus wird die Energiegewinnung reduziert und die Zellvermehrung wird gestoppt. Darüber hinaus wird die Blutgefäßneubildung, ein wichtiger Mechanismus der „Ernährung“ von Krebszellen, blockiert. Das Arzneimittel kommt ursprünglich aus der Transplantationsmedizin, da es auch Teile des Immunsystems unterdrücken kann. Eine weitere Zulassung besteht beim fortgeschrittenen Nierenzellkarzinom. Die mTOR-Hemmung unterbricht das Wachstum von Krebszellen auf verschiedenen Wegen und ist als Therapie bei bestimmten Krebsformen wirksam. Die Therapie mit Everolimus wird in den klinischen Studien als eine Kombinationstherapie mit Imatinib durchgeführt.
Als Nebenwirkungen können auftreten: Entzündungen der Mundschleimhaut, die durch vorbeugendes Spülen verhindert oder gemildert werden können, Hautausschläge mit Hauttrockenheit und Juckreiz sowie ein Ansteigen des Blutzuckerspiegels. Bei Bedarf muss eine entsprechende antidiabetische Therapie eingeleitet werden.
Imatinib-Reinduktion: Einen weiteren Ansatz der Drittlinientherapie des GIST stellt auch ein Wiedereinsatz (Re-Induktion) von Imatinib, nach Fortschreiten der Erkrankung unter Sunitinib oder anderen zielgerichteten Therapien, dar. Es gibt einige Belege, dass eine Wiedereinführung die Krankheitsprogression verzögern kann.
Die Chirurgie spielt in der palliativen Therapie des GIST nur eine untergeordnete Rolle. Der Einsatz des Chirurgen ist lediglich bei lokalen Komplikationen, wie Darmverschluss, Blutungen, Perforationen, Infektionen, die nicht konservativ beherrscht werden können, vonnöten.
— Evelyne Bareck, Thomas Brodowicz, und Wolfgang Eisterer